楊飄萍/李春霞/林君Coord. Chem. Rev.長篇綜述:內(nèi)源性外源性刺激觸發(fā)的納米平臺用于增強(qiáng)化學(xué)動力學(xué)治療的最新進(jìn)展
發(fā)布時(shí)間:2021-11-25 19:02:44 人氣:1971
哈爾濱工程大學(xué)楊飄萍教授、山東大學(xué)李春霞教授和中科院長春應(yīng)化所林君研究員合作發(fā)表《Coord. Chem. Rev.》長篇綜述:內(nèi)源性/外源性刺激觸發(fā)的納米平臺用于增強(qiáng)化學(xué)動力學(xué)治療的最新進(jìn)展。

鑒于腫瘤微環(huán)境(TME)某些獨(dú)特的內(nèi)化特征(主要包括缺氧、酸性、較高濃度的H2O2和谷胱甘肽(GSH)等),人們引入了先進(jìn)的納米技術(shù)來提高細(xì)胞內(nèi)的活性氧(ROS)水平,主要涉及過渡金屬的芬頓和類芬頓反應(yīng)、金屬催化反應(yīng)和過氧化物酶催化反應(yīng),用于腫瘤的化學(xué)動力學(xué)治療(CDT)。然而,存在許多不可避免的問題,如鐵基材料的芬頓反應(yīng)條件苛刻,反應(yīng)效率低,內(nèi)源性H2O2有限,抗氧化系統(tǒng)中和產(chǎn)生的ROS,單一CDT模式的治療效果不理想等,嚴(yán)重限制了CDT在抗癌領(lǐng)域的應(yīng)用,而這又恰好促進(jìn)了具有更好治療效果的增強(qiáng)型CDT納米平臺的產(chǎn)生和發(fā)展。近日,哈爾濱工程大學(xué)楊飄萍教授、山東大學(xué)李春霞教授和中科院長春應(yīng)化所林君研究員對增強(qiáng)型CDT抗腫瘤策略進(jìn)行了綜述,即在國際著名化學(xué)期刊Coordination Chemistry Reviews (IF:22.3)發(fā)表了題為“Recent advances on endogenous/exogenous stimuli-triggered nanoplatforms for enhanced chemodynamic therapy”的長篇綜述文章(篇幅長達(dá)70頁),旨在對近年來出現(xiàn)的強(qiáng)化CDT抗腫瘤策略進(jìn)行系統(tǒng)的討論、分類和深入的回顧、總結(jié),涉及由內(nèi)源性/外源性刺激引發(fā)的氧化應(yīng)激的放大策略。內(nèi)源性刺激主要來自TME或癌細(xì)胞內(nèi)部(如酸性pH值、葡萄糖、GSH、一些特定的酶等),外源性刺激包括光、熱和超聲等。這里根據(jù)這些刺激的來源將增強(qiáng)型CDT納米材料分為三大類,即內(nèi)源性刺激反應(yīng)型納米材料、外源性刺激反應(yīng)型納米材料和內(nèi)源性/外源性共刺激反應(yīng)型納米材料。作者從材料的合理設(shè)計(jì)和制備、作用機(jī)制與潛在的醫(yī)學(xué)應(yīng)用等方面對代表性例子進(jìn)行了剖析和討論。最后,總結(jié)了目前CDT發(fā)展中遇到的困難和瓶頸,并指出了該領(lǐng)域未來發(fā)展的初步方向,以努力調(diào)動、協(xié)調(diào)生物學(xué)和化學(xué)的潛在力量。
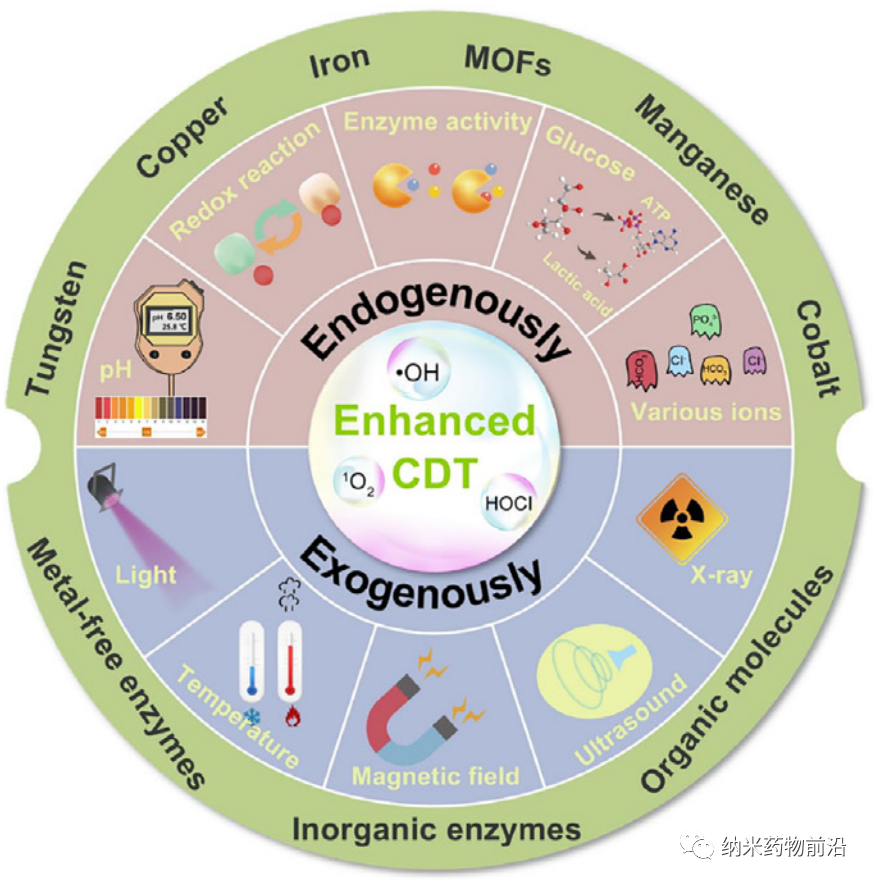
本文的主要內(nèi)容包括:
第一部分(緒論)介紹了ROS的類型、來源和生物學(xué)功能,ROS介導(dǎo)的CDT的產(chǎn)生和治療優(yōu)勢,以及撰寫本綜述的目的。
第二部分(傳統(tǒng)的基于芬頓反應(yīng)的CDT)主要介紹了基于芬頓反應(yīng)的提升細(xì)胞內(nèi)氧化應(yīng)激策略、限制其進(jìn)一步發(fā)展的幾個(gè)主要問題,以及相應(yīng)的解決方案。
第三部分(內(nèi)部微環(huán)境刺激)介紹了利用TME的獨(dú)特特征(如pH值、氧化還原環(huán)境、高表達(dá)酶、糖酵解過程、離子等)啟動高效CDT的各種策略,包括單一內(nèi)源性刺激反應(yīng)策略、兩個(gè)或多個(gè)內(nèi)源性刺激反應(yīng)策略。
第四部分(外部能量場的刺激)主要討論外部刺激(如光、熱、超聲波和X射線)響應(yīng)型納米平臺在增強(qiáng)CDT抗癌領(lǐng)域中的應(yīng)用。
第五部分(內(nèi)源性/外源性共刺激響應(yīng)型CDT納米平臺)介紹了TME內(nèi)部調(diào)控或TME與外部刺激響應(yīng)的多重刺激響應(yīng)型CDT納米平臺,包括糖酵解/熱、氧化還原反應(yīng)/熱、酶/熱、pH/熱、pH/熱/氧化還原反應(yīng)以及其他多響應(yīng)性納米系統(tǒng)。
第六部分(其他響應(yīng)性)介紹了另外三個(gè)響應(yīng)性增強(qiáng)CDT的納米平臺,包括基于阻斷腫瘤細(xì)胞自噬、利用內(nèi)源性H2S刺激建立高效的Fe3+/Fe2+轉(zhuǎn)換體系、以及用于增強(qiáng)CDT的細(xì)菌生物反應(yīng)器。
第七部分(結(jié)論和展望方向)主要是對本文進(jìn)行總結(jié),指出增強(qiáng)型CDT納米平臺目前面臨的幾個(gè)關(guān)鍵問題,并對今后的研究工作提出一些相應(yīng)的建議和意見,以期盡快實(shí)現(xiàn)CDT的下一步快速發(fā)展。
本文第一作者是來自哈爾濱工程大學(xué)的博士研究生孫倩倩,通訊作者是哈爾濱工程大學(xué)楊飄萍教授、山東大學(xué)李春霞教授和中科院長春應(yīng)化所林君研究員。本文獲得國家自然科學(xué)基金、黑龍江省自然科學(xué)基金、山東省自然科學(xué)基金、中國博士后科學(xué)基金和中央高校基礎(chǔ)研究基金等支持。
文獻(xiàn)鏈接:
https://www.sciencedirect.com/science/article/pii/S0010854521005415?via%3Dihub
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 ,如有侵權(quán)請聯(lián)系我們立即刪除。
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請以實(shí)物為主,如有侵權(quán)請聯(lián)系我們立即刪除。 |


