Nature Medicine:兩性離子水凝膠可有效擴(kuò)增人類造血干細(xì)胞
發(fā)布時(shí)間:2020-12-17 14:31:17 人氣:2235
造血干細(xì)胞(HSPC)移植是血液系統(tǒng)惡性腫瘤最重要的治愈性療法,臍帶血是HSPC的重要來(lái)源,其具有白細(xì)胞抗原匹配要求不嚴(yán)格的獨(dú)特優(yōu)勢(shì),可為移植臍帶血的患者降低免疫排斥的風(fēng)險(xiǎn),因而被廣泛被應(yīng)用于HSPC移植。但臍帶血所含HSPC數(shù)量有限,會(huì)延遲患者造血功能的恢復(fù),最終影響臨床的治療效果。為了增加可用于臨床移植的HSPC數(shù)量,研究人員長(zhǎng)期以來(lái)一直在尋找適合離體擴(kuò)增HSPC的培養(yǎng)條件。
研究人員利用ZTG opt與優(yōu)化的Delta1 ext-IgG(DXI)以及作為未修飾的TCPS培養(yǎng)瓶三種方式分別培養(yǎng)HSPC,發(fā)現(xiàn)ZTG opt培養(yǎng)后,該HSPC的原始細(xì)胞同質(zhì)性得以保留,而DXI 與TCPS培養(yǎng)瓶的培養(yǎng)方式均會(huì)導(dǎo)致細(xì)胞出現(xiàn)顆粒狀胞質(zhì)和不規(guī)則的核等異質(zhì)性表型。如圖2所示,在整個(gè)培養(yǎng)期間,ZTG opt種群保持CD34高表達(dá),ZTG opt擴(kuò)增后的細(xì)胞中CD34 +占93.7%±2%,表明ZTG水凝膠3D培養(yǎng)方式可抑制HSPC分化。
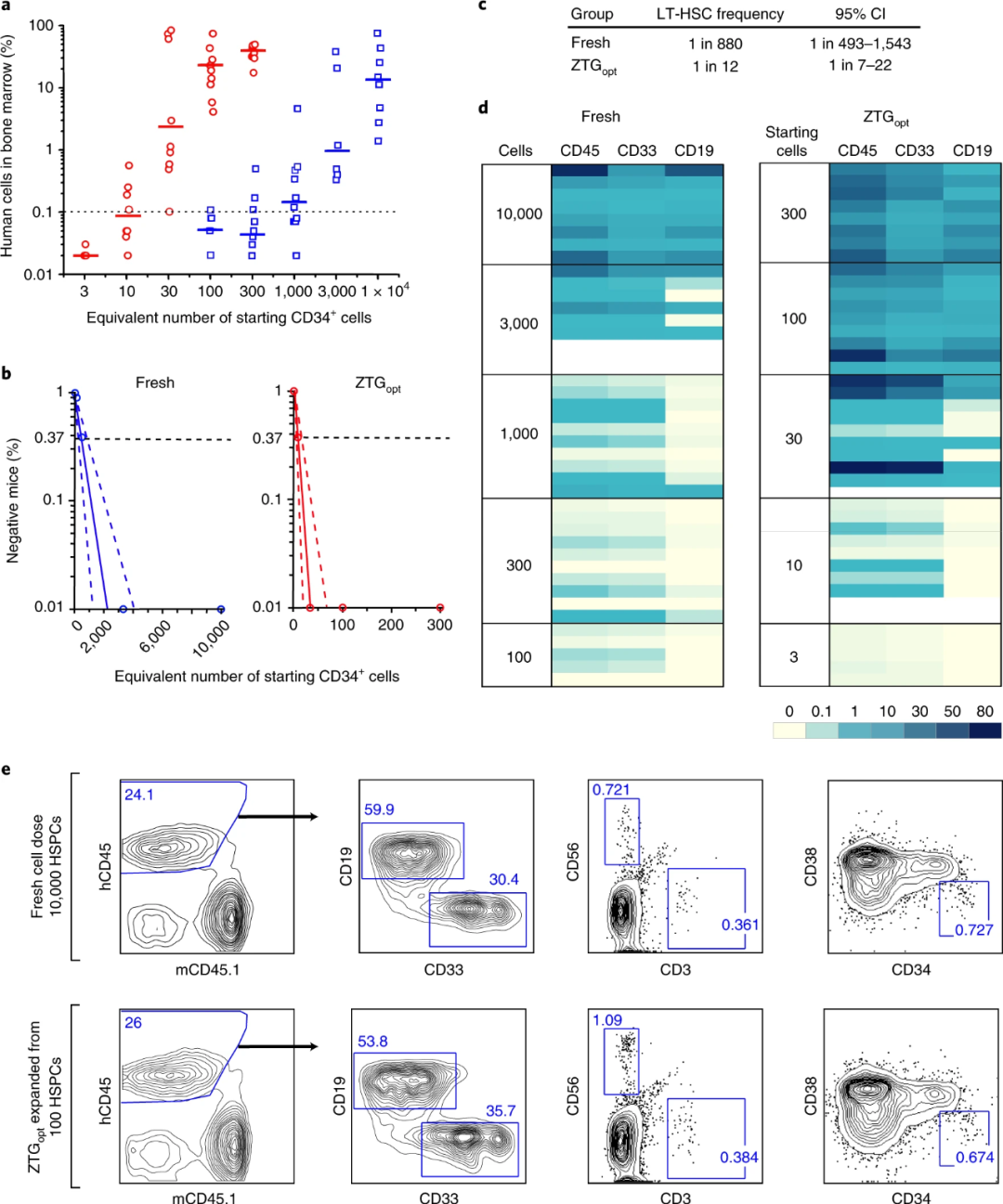
ZTG opt方式培養(yǎng)的臍帶血來(lái)源的CD34 + HSPC在體內(nèi)可保持?jǐn)U增能力已得到證明,研究人員又利用有限稀釋分析(LDA)來(lái)檢測(cè)中長(zhǎng)期再生造血干細(xì)胞(LT-HSC)的擴(kuò)增頻率的情況。實(shí)驗(yàn)結(jié)果如圖3所示,在移植后24–30周后,ZTG opt方式培養(yǎng)的LT-HSC的擴(kuò)增頻率遠(yuǎn)高于其他培養(yǎng)方式。有限稀釋分析和二次移植實(shí)驗(yàn)均證明ZTG培養(yǎng)擴(kuò)增了具有長(zhǎng)期造血功能的LT-HSC細(xì)胞。
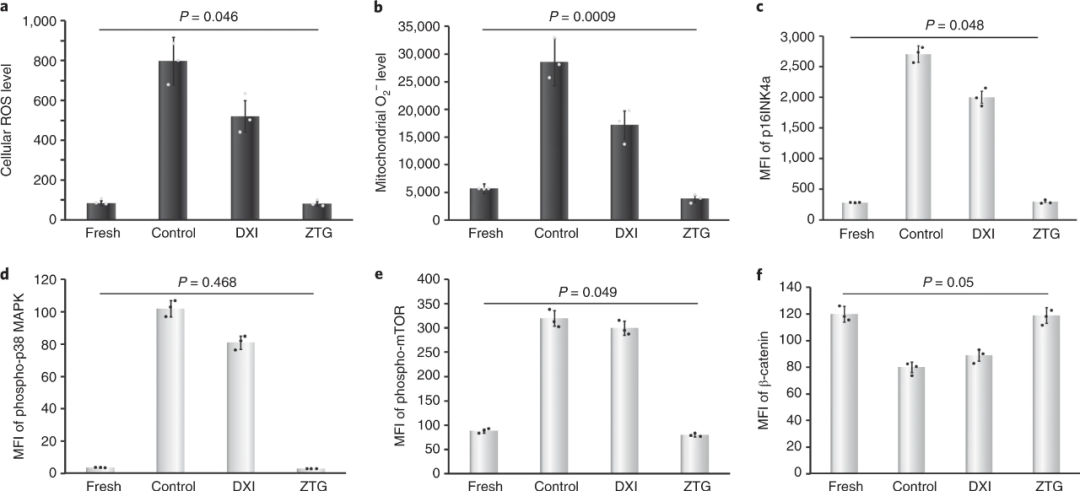
在正常生理狀態(tài)下,原始的HSPC駐留在低氧的生態(tài)位中,可限制細(xì)胞產(chǎn)生ROS進(jìn)行自我保護(hù)。為了探討了 ZTG 水凝膠3D培養(yǎng)是否可以限制ROS的產(chǎn)生并保護(hù)封裝的HSPC,研究人員檢測(cè)了各系統(tǒng)中培養(yǎng)1天后的細(xì)胞反應(yīng),如圖4所示,對(duì)比DXI組和對(duì)照組,ZTG組的細(xì)胞ROS和線粒體超氧化物水平偏低且非特異性信號(hào)通路無(wú)明顯激活,有利于HSPC增強(qiáng)自我更新。
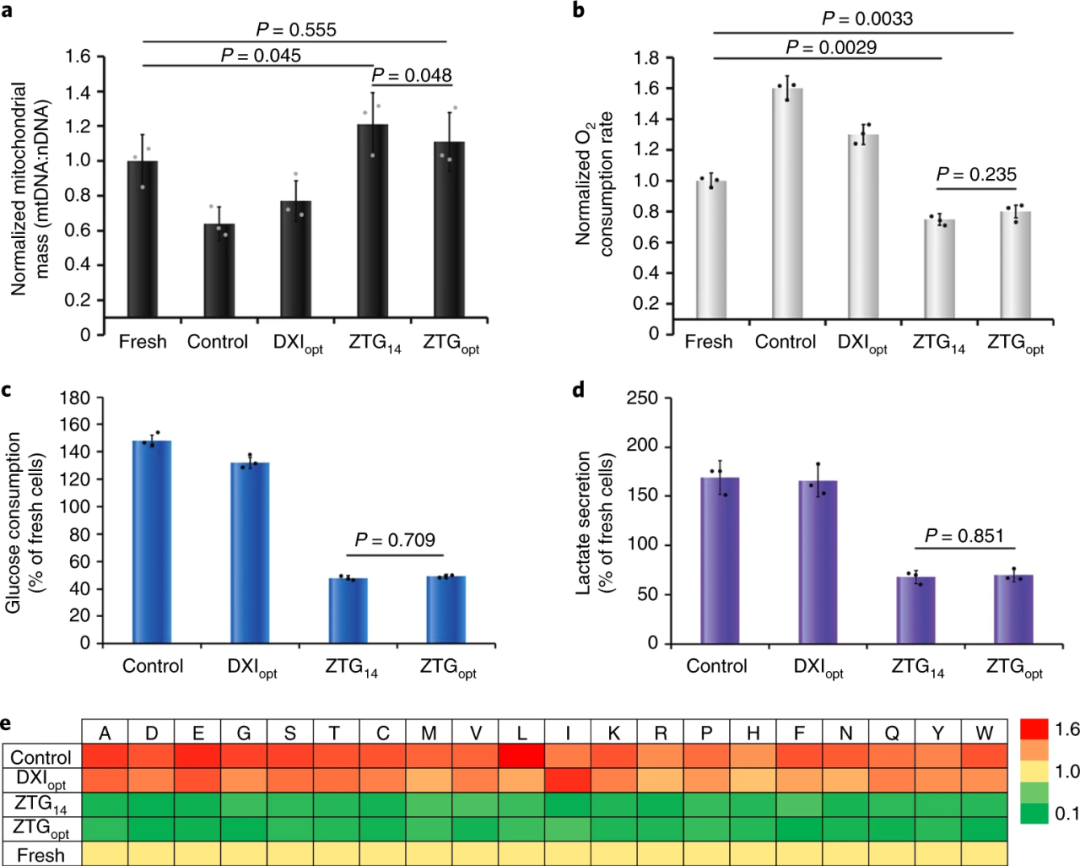
此外,研究人員通過(guò)分析ZTG14,ZTGopt和其他擴(kuò)增方式培養(yǎng)的細(xì)胞內(nèi)線粒體質(zhì)量和代謝活性,發(fā)現(xiàn)ZTG14和ZTGopt細(xì)胞中線粒體質(zhì)量略有增加,與DXIopt和對(duì)照組的顯著下降形成鮮明對(duì)比,另外葡萄糖消耗和乳酸分泌量也遠(yuǎn)低于DXIopt和對(duì)照組。實(shí)驗(yàn)結(jié)果如圖5所示,表明ZTG培養(yǎng)中O2相關(guān)的代謝受抑制,再次證明 ZTG水凝膠3D培養(yǎng)方式保持了原始的HSPC特性。
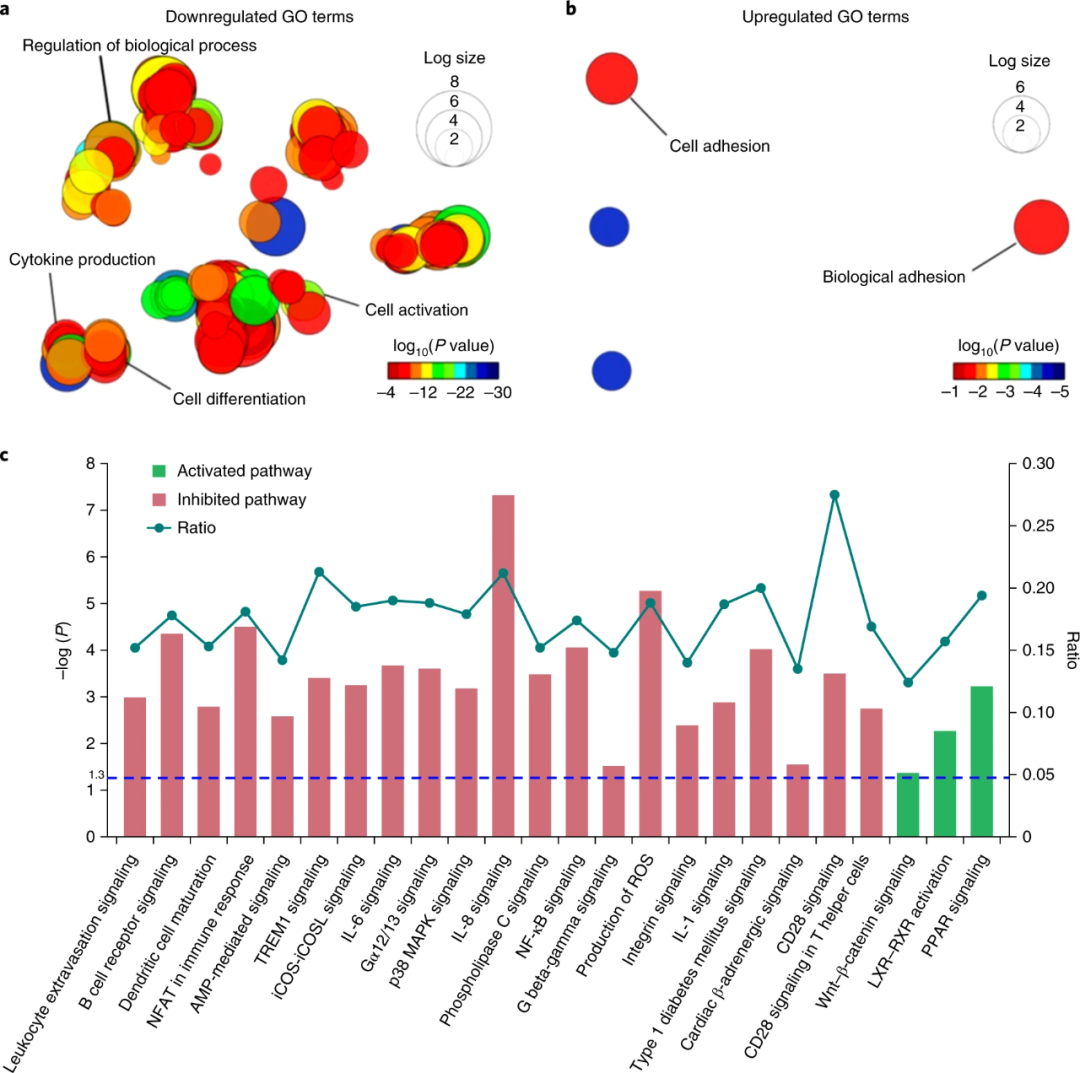
為了更深入地了解ZTG水凝膠內(nèi)的CD34 + HSPC的活性,研究人員利用mRNA深度測(cè)序(RNA-seq)進(jìn)行了基因表達(dá)譜分析。如圖6所示,與新鮮分離的原代HSPC相比,超過(guò)10,000個(gè)基因的表達(dá)在ZTG培養(yǎng)的HSPC中沒(méi)有顯著變化。對(duì)比其他培養(yǎng)方式,ZTG培養(yǎng)組中與細(xì)胞分化,細(xì)胞活化和細(xì)胞因子產(chǎn)生相關(guān)的基因顯著下調(diào),再次表明ZTG培養(yǎng)方式可減緩細(xì)胞代謝過(guò)程。
來(lái)自美國(guó)華盛頓大學(xué)的Colleen Delaney教授和Shaoyi Jiang教授共同在Nature Medicine雜志上發(fā)表了題目為“Expansion of primitive human hematopoietic stem cells by culture in a zwitterionic hydrogel”的研究性論文,揭示可降解的兩性離子水凝膠3D培養(yǎng)人類HSPC,能夠抑制HSPC分化,并有效擴(kuò)增臍帶血和骨髓來(lái)源的HSPC,為人類血液系統(tǒng)惡性腫瘤治療帶來(lái)了新的希望。
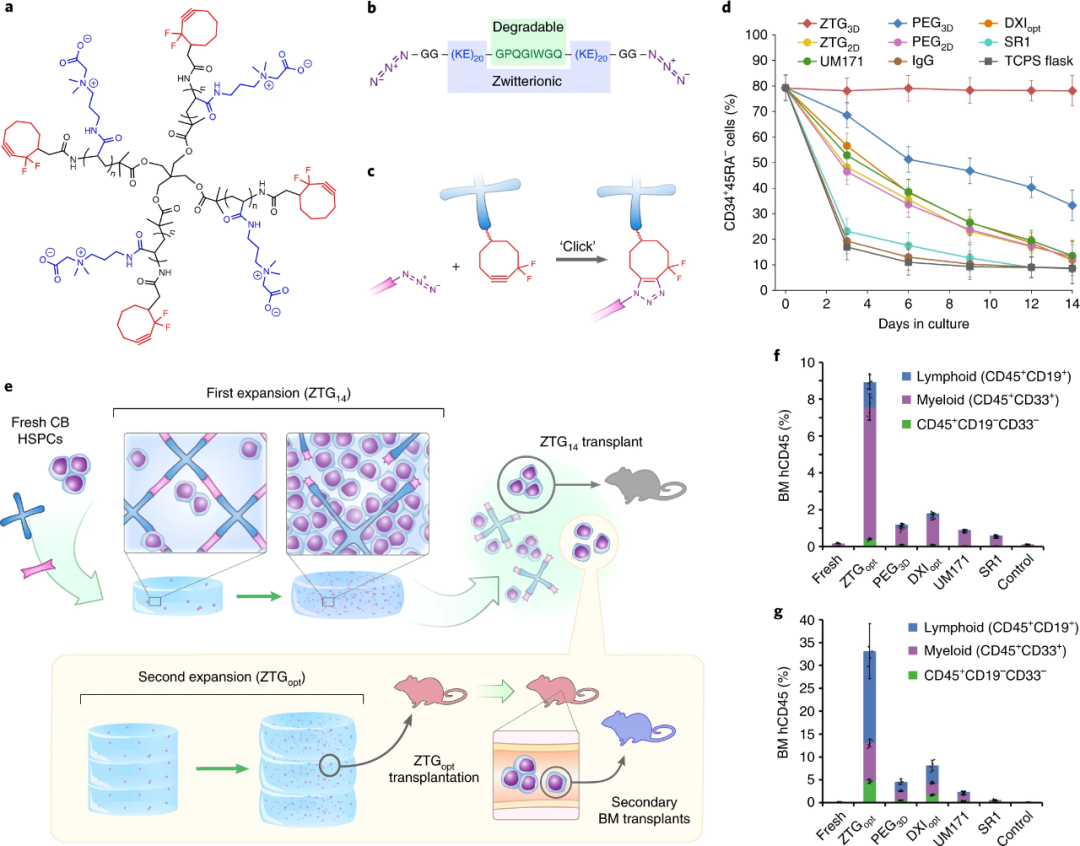
研究人員利用ZTG opt與優(yōu)化的Delta1 ext-IgG(DXI)以及作為未修飾的TCPS培養(yǎng)瓶三種方式分別培養(yǎng)HSPC,發(fā)現(xiàn)ZTG opt培養(yǎng)后,該HSPC的原始細(xì)胞同質(zhì)性得以保留,而DXI 與TCPS培養(yǎng)瓶的培養(yǎng)方式均會(huì)導(dǎo)致細(xì)胞出現(xiàn)顆粒狀胞質(zhì)和不規(guī)則的核等異質(zhì)性表型。如圖2所示,在整個(gè)培養(yǎng)期間,ZTG opt種群保持CD34高表達(dá),ZTG opt擴(kuò)增后的細(xì)胞中CD34 +占93.7%±2%,表明ZTG水凝膠3D培養(yǎng)方式可抑制HSPC分化。
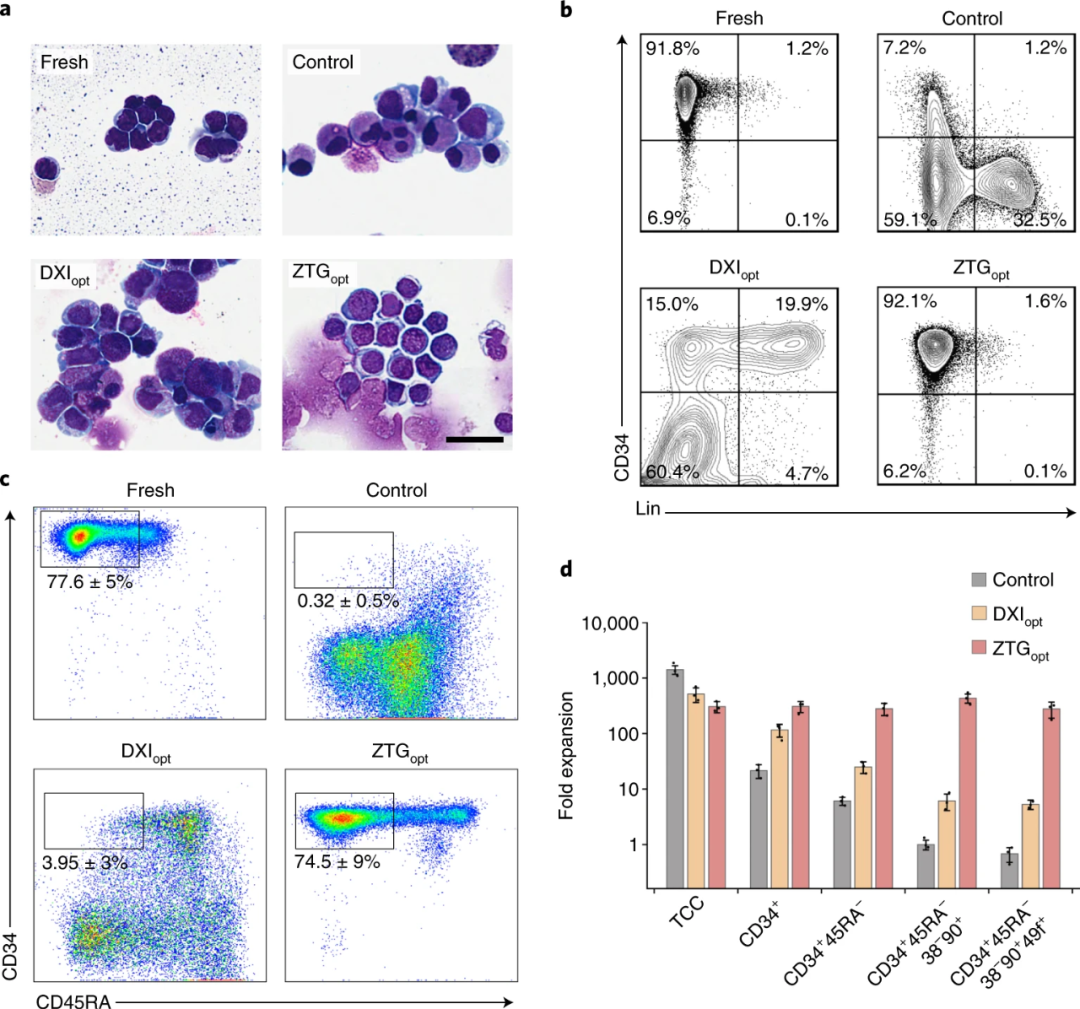
ZTG opt方式培養(yǎng)的臍帶血來(lái)源的CD34 + HSPC在體內(nèi)可保持?jǐn)U增能力已得到證明,研究人員又利用有限稀釋分析(LDA)來(lái)檢測(cè)中長(zhǎng)期再生造血干細(xì)胞(LT-HSC)的擴(kuò)增頻率的情況。實(shí)驗(yàn)結(jié)果如圖3所示,在移植后24–30周后,ZTG opt方式培養(yǎng)的LT-HSC的擴(kuò)增頻率遠(yuǎn)高于其他培養(yǎng)方式。有限稀釋分析和二次移植實(shí)驗(yàn)均證明ZTG培養(yǎng)擴(kuò)增了具有長(zhǎng)期造血功能的LT-HSC細(xì)胞。
在正常生理狀態(tài)下,原始的HSPC駐留在低氧的生態(tài)位中,可限制細(xì)胞產(chǎn)生ROS進(jìn)行自我保護(hù)。為了探討了 ZTG 水凝膠3D培養(yǎng)是否可以限制ROS的產(chǎn)生并保護(hù)封裝的HSPC,研究人員檢測(cè)了各系統(tǒng)中培養(yǎng)1天后的細(xì)胞反應(yīng),如圖4所示,對(duì)比DXI組和對(duì)照組,ZTG組的細(xì)胞ROS和線粒體超氧化物水平偏低且非特異性信號(hào)通路無(wú)明顯激活,有利于HSPC增強(qiáng)自我更新。
此外,研究人員通過(guò)分析ZTG14,ZTGopt和其他擴(kuò)增方式培養(yǎng)的細(xì)胞內(nèi)線粒體質(zhì)量和代謝活性,發(fā)現(xiàn)ZTG14和ZTGopt細(xì)胞中線粒體質(zhì)量略有增加,與DXIopt和對(duì)照組的顯著下降形成鮮明對(duì)比,另外葡萄糖消耗和乳酸分泌量也遠(yuǎn)低于DXIopt和對(duì)照組。實(shí)驗(yàn)結(jié)果如圖5所示,表明ZTG培養(yǎng)中O2相關(guān)的代謝受抑制,再次證明 ZTG水凝膠3D培養(yǎng)方式保持了原始的HSPC特性。
為了更深入地了解ZTG水凝膠內(nèi)的CD34 + HSPC的活性,研究人員利用mRNA深度測(cè)序(RNA-seq)進(jìn)行了基因表達(dá)譜分析。如圖6所示,與新鮮分離的原代HSPC相比,超過(guò)10,000個(gè)基因的表達(dá)在ZTG培養(yǎng)的HSPC中沒(méi)有顯著變化。對(duì)比其他培養(yǎng)方式,ZTG培養(yǎng)組中與細(xì)胞分化,細(xì)胞活化和細(xì)胞因子產(chǎn)生相關(guān)的基因顯著下調(diào),再次表明ZTG培養(yǎng)方式可減緩細(xì)胞代謝過(guò)程。
綜上所述,兩性離子水凝膠3D培養(yǎng)可作為有效的離體擴(kuò)增HSPC方式,有望提高臨床意義上的可移植HSPC的絕對(duì)數(shù)量。同時(shí),該水凝膠培養(yǎng)體系為胚胎干細(xì)胞,誘導(dǎo)性多能干細(xì)胞,間充質(zhì)干細(xì)胞等其他干細(xì)胞類型的擴(kuò)展策略提供了參考。
信息來(lái)源: EngineeringForLife
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請(qǐng)以實(shí)物為主,如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除。 |
上一篇:沒(méi)有了...


